آلبومين چيست؟
آلبومين پروتئيني است كه توسط كبد ساخته مي شود
آلبومين فراوان ترين پروتئين در گردش خون است.
غلظت آلبومين پلاسما به طور معمول بين 35 تا 50 گرم در ليتر است.
آلبومين فشار اسمزي كلوئيدي پلاسما را تشكيل مي دهد
و داراي مكانهاي اتصال با ميل زيادي براي بسياري از تركيبات طبيعي است ، از جمله بيلي روبين و بسياري از داروها.
آلبومين همچنين يك كلوئيد داخل عروقي مهم است،
عملكرد و ساختار آلبومين
بسياري از سلول ها قادرند از آلبومين به عنوان منبع اسيدهاي آمينه استفاده كرده و با پينوسيتوز آن را جذب كنند.
آلبومين باعث نشت مايعات از رگ هاي خوني ، تغذيه بافت ها و انتقال هورمون ها ، ويتامين ها ، داروها و موادي مانند كلسيم به بدن مي شود.
وقتي كليه ها شروع به از كار افتادن مي كنند ، آلبومين به ادرار شما نشت مي كند.
اين باعث پايين آمدن سطح آلبومين در خون شما مي شود.
تغييرات در غلظت آلبومين پلاسما بايد با احتياط تفسير شود زيرا شرايط ديگري غير از بيماري كبدي است
كه ممكن است منجر به سطح آلبومين پلاسما پايين شود.
عملكرد آلبومين بر روي بدن :
- داشتن سلامتي
- مقابله با عفونت ها
- جلوگيري از تحليل عضلات
- بهبودي سريعتر پس از بيماري يا جراحي
- كمك به بدن حين دياليز
چگونه مي توان فهميد كه پروتئين كافي مصرف مي كنم؟
ميزان آلبومين در بدن شما از طريق آزمايشگاه هاي معمولي اندازه گيري مي شود.
سطح آلبومين سالم 4.0 يا بالاتر است. اگر سطح آلبومين شما كمتر از 4.0 باشد ، ممكن است پروتئين كافي مصرف نكنيد.
همچنين عوامل ديگري نيز وجود دارد كه مي تواند بر سطح آلبومين شما تأثير بگذارد
مانند:عفونت ، آسيب يا بيماري.
علائم آلبومين پايين مي تواند افزايش قند خون ، تورم در پاها و دستان ، ضعف يا خستگي ، حالت تهوع يا تغيير اشتها و خشكي يا خارش پوست باشد.
كه البته براي اطمينان بايد بررسي هاي آزمايشگاهي صورت بگيرد .
خريد آلبومين
در صورت تمايل به خريد آلبومين مي توانيد با شماره هاي درج شده در وب سايت با ما در تماس باشيد تا همكاران ما اطلاعات كامل در اين زمينه را به همراه قيمت آلبومين در اختيار شما قرار دهند .
خانه / مواد شيميايي / اسيدها
يد
دسته: اسيدها, مواد شيميايي
يد مرك: 104761
Merck iodine:104761
يد چيست؟
يد عنصري غير فلزي ،در رنگ هاي خاكستري تيره سياه بنفش براق ، به صورت جامد است. يد اگر قادربه انجام باشد مي تواند تركيباتي با عناصر زيادي تشكيل دهد ، الكتروپوزيترين هالوژن و كم واكنش ترين هالوژن ها است. يد به آساني با حرارت دادن بخار بنفش ايجاد ميكند . يد در يسري از حلال ها مانند تتراكلريد كربن حل مي شود و فقط كمي در آب حل مي شود كه در اين صورت محلول يد به دست مي آيد
از يد به عنوان يك تنتور و يديوفرم براي درمان هاي پزشكي استفاده مي شود ،از اين ماده در تهيه داروهاي خاص و در ساخت برخي از جوهرهاي چاپ و رنگ استفاده مي شود. از يد نقره در عكاسي مورد استفاده قرار ميگيرد. يد تقريباً به تمام نمك سفره اضافه مي شود و به عنوان مكمل خوراك دام مورد مصرف قرار مي گيرد. اين ماده همچنين از تركيبات قرص هاي تصفيه آب است كه براي تهيه آب آشاميدني استفاده مي شود.
براي بسياري از اين كاربردها يد به يديد تبديل مي شود.
يد در محيط
يد تقريباً به هر نوع نمكي كه قابل استفاده باشد اضافه مي شود. اين ماده نان ، ماهي دريايي و گياهان اقيانوسي است. يد به طور طبيعي در اقيانوس وجود دارد و برخي از ماهيان دريايي و گياهان آب آن را در بافت هاي خود ذخيره مي كنند.
يد را مي توان به طور طبيعي در هوا ، آب و خاك پيدا كرذ. مهمترين منابع يد طبيعي اقيانوسها هستند. سالانه حدود 400000 تن يد به عنوان يديد در اسپري دريا يا به عنوان يديد ، اسيد هيدروكلريك و متيل يديد كه توسط ارگانيسم هاي دريايي توليد مي شود ، از اقيانوس ها فرار مي كند. قسمت عمده اي از آن در زميني نهشته مي شود كه ممكن است به بخشي از دوچرخه تبديل شود.
برخي مواد معدني حاوي يد وجود دارد ، مانند آلوتاريت كه در شيلي و يدارژيت پيدا مي شود و در كلرادو ، نوادا و نيومكزيكو پيدامي شود. توليد جهاني يد در سراسر جهان حدود 13000 تن درطول سال است ، عمدتا در شيلي و ژاپن ، به علاوه مقدار كمي در روسيه و ايالات متحده. يد از آب نمك طبيعي و آب نمك روغن استخراج مي شود كه حداكثر 100 ppm عنصر دارد يا رسوبات نيترات شيلي تشكيل مي دهد. ميزان ذخاير شناخته شده يد كه به راحتي قابل دسترسي است حدود 2 ميليون تن استمبسياري از داروها و پاك كننده هاي زخم هاي پوستي حاوي يد هستند.
اثرات يد بر سلامتي
يد يك ماده ساختماني از هورمونهاي تيروئيد است كه براي رشد ، سيستم عصبي و متابوليسم ضروري است. انسانهايي كه نان كمي مي خورند و كم مي خورند مي توانند كمبود يد را تجربه كنند. غده تيروئيد كندتر عملكردخود را انجام ميدهد. و تورم غده تيروئيد شروع مي شود. اين پديده را استروما نامگذاري ميكنند. اين شرايط اكنون است زيرا نمك خوراكي با مقدار كمي يد مصرف مي شود. مقادير زياد يد مي تواند خطرناك باشد زيرا غده تيروئيد خيلي شتابزده عمل مي كند. اين كل بدن را تحت تأثير قرار مي دهد. باعث اختلال در ضربان قلب و كاهش وزن مي شود.
يد عنصري ، I2 سمي است و بخار آن چشم و ريه ها را تحريك مي كند. حداكثر غلظت مجاز در هوا هنگام كار با يد فقط 1 ميلي گرم در متر ميباشد. تمام يديدها در صورت مصرف بيش از حد سمي ميباشند.
يد 131 يكي از راديونوكلئيدهاي شركت كننده در آزمايش جوي سلاح هاي هسته اي است كه از سال 1945 با آزمايش آمريكا آغاز شد و در سال 1980 با آزمايش چيني به پايان رسيد. اين يكي از راديونوكليدهاي با عمر طولاني است كه خطر ابتلا به سرطان را براي دهه ها و قرن هاي آينده افزايش داده و ادامه خواهد داد. يد 131 خطر سرطان و احتمالاً ساير بيماريهاي تيروئيد و ناشي از كمبود هورموني تيروئيد را افزايش مي دهد.
انواع محلول
- محلول مايع
- محلول پودر
خريد يد
مشتريان ارجمند اگر نياز به خريد يد داريد مي توانيد جهت دريافت ليست قيمت با شماره هاي ماينو لب ما در تماسباشيد تا همكاران ما شما در خريد اين محصول ياري گردانند.
خانه / مواد شيميايي / اسيدها
يد
دسته: اسيدها, مواد شيميايي
يد مرك: 104761
Merck iodine:104761
يد چيست؟
يد عنصري غير فلزي ،در رنگ هاي خاكستري تيره سياه بنفش براق ، به صورت جامد است. يد اگر قادربه انجام باشد مي تواند تركيباتي با عناصر زيادي تشكيل دهد ، الكتروپوزيترين هالوژن و كم واكنش ترين هالوژن ها است. يد به آساني با حرارت دادن بخار بنفش ايجاد ميكند . يد در يسري از حلال ها مانند تتراكلريد كربن حل مي شود و فقط كمي در آب حل مي شود كه در اين صورت محلول يد به دست مي آيد
از يد به عنوان يك تنتور و يديوفرم براي درمان هاي پزشكي استفاده مي شود ،از اين ماده در تهيه داروهاي خاص و در ساخت برخي از جوهرهاي چاپ و رنگ استفاده مي شود. از يد نقره در عكاسي مورد استفاده قرار ميگيرد. يد تقريباً به تمام نمك سفره اضافه مي شود و به عنوان مكمل خوراك دام مورد مصرف قرار مي گيرد. اين ماده همچنين از تركيبات قرص هاي تصفيه آب است كه براي تهيه آب آشاميدني استفاده مي شود.
براي بسياري از اين كاربردها يد به يديد تبديل مي شود.
يد در محيط
يد تقريباً به هر نوع نمكي كه قابل استفاده باشد اضافه مي شود. اين ماده نان ، ماهي دريايي و گياهان اقيانوسي است. يد به طور طبيعي در اقيانوس وجود دارد و برخي از ماهيان دريايي و گياهان آب آن را در بافت هاي خود ذخيره مي كنند.
يد را مي توان به طور طبيعي در هوا ، آب و خاك پيدا كرذ. مهمترين منابع يد طبيعي اقيانوسها هستند. سالانه حدود 400000 تن يد به عنوان يديد در اسپري دريا يا به عنوان يديد ، اسيد هيدروكلريك و متيل يديد كه توسط ارگانيسم هاي دريايي توليد مي شود ، از اقيانوس ها فرار مي كند. قسمت عمده اي از آن در زميني نهشته مي شود كه ممكن است به بخشي از دوچرخه تبديل شود.
برخي مواد معدني حاوي يد وجود دارد ، مانند آلوتاريت كه در شيلي و يدارژيت پيدا مي شود و در كلرادو ، نوادا و نيومكزيكو پيدامي شود. توليد جهاني يد در سراسر جهان حدود 13000 تن درطول سال است ، عمدتا در شيلي و ژاپن ، به علاوه مقدار كمي در روسيه و ايالات متحده. يد از آب نمك طبيعي و آب نمك روغن استخراج مي شود كه حداكثر 100 ppm عنصر دارد يا رسوبات نيترات شيلي تشكيل مي دهد. ميزان ذخاير شناخته شده يد كه به راحتي قابل دسترسي است حدود 2 ميليون تن استمبسياري از داروها و پاك كننده هاي زخم هاي پوستي حاوي يد هستند.
اثرات يد بر سلامتي
يد يك ماده ساختماني از هورمونهاي تيروئيد است كه براي رشد ، سيستم عصبي و متابوليسم ضروري است. انسانهايي كه نان كمي مي خورند و كم مي خورند مي توانند كمبود يد را تجربه كنند. غده تيروئيد كندتر عملكردخود را انجام ميدهد. و تورم غده تيروئيد شروع مي شود. اين پديده را استروما نامگذاري ميكنند. اين شرايط اكنون است زيرا نمك خوراكي با مقدار كمي يد مصرف مي شود. مقادير زياد يد مي تواند خطرناك باشد زيرا غده تيروئيد خيلي شتابزده عمل مي كند. اين كل بدن را تحت تأثير قرار مي دهد. باعث اختلال در ضربان قلب و كاهش وزن مي شود.
يد عنصري ، I2 سمي است و بخار آن چشم و ريه ها را تحريك مي كند. حداكثر غلظت مجاز در هوا هنگام كار با يد فقط 1 ميلي گرم در متر ميباشد. تمام يديدها در صورت مصرف بيش از حد سمي ميباشند.
يد 131 يكي از راديونوكلئيدهاي شركت كننده در آزمايش جوي سلاح هاي هسته اي است كه از سال 1945 با آزمايش آمريكا آغاز شد و در سال 1980 با آزمايش چيني به پايان رسيد. اين يكي از راديونوكليدهاي با عمر طولاني است كه خطر ابتلا به سرطان را براي دهه ها و قرن هاي آينده افزايش داده و ادامه خواهد داد. يد 131 خطر سرطان و احتمالاً ساير بيماريهاي تيروئيد و ناشي از كمبود هورموني تيروئيد را افزايش مي دهد.
انواع محلول
- محلول مايع
- محلول پودر
خريد يد
مشتريان ارجمند اگر نياز به خريد يد داريد مي توانيد جهت دريافت ليست قيمت با شماره هاي ماينو لب ما در تماسباشيد تا همكاران ما شما در خريد اين محصول ياري گردانند.
خانه / مواد شيميايي / بافرها
تريس
تريس: 108387
tris: 108387
بافر تريس چيست ؟
تريس يك تركيب آلي است كه اغلب در محلول هاي بافر مانند TAE يا TBE براي ژل هاي الكتروفورز استفاده مي شود. بافر تريس در آب بسيار محلول است
و در محدوده pH 7.0-9.0 مفيد است. در تهيه بافر Laemmli ، يكي از رايج ترين بافرهاي SDS-PAGE استفاده مي شود. علاوه بر اين ، Tris همچنين مي تواند براي بسياري از بافرهاي سفارشي در حال اجرا و بارگيري ، اغلب با گليسين و SDS استفاده شود.
هنگام تعيين pH محلول حاوي بافر Tris بايد از استفاده از الكترودهاي pH كه حاوي نقره هستند ، خودداري شود.
ساختار شيميايي تريس چگونه است؟
2-Amino-2-(hydroxymethyl)-1,3-propanediol
موارد استفاده از بافر Tris در الكتروفورز پروتئين و وسترن بلات
بافرهاي تريس يكپارچه در الكتروفورز پروتئين و وسترن بلات هستند. بيشتر ژل هاي SDS-PAGE ، بافرهاي در حال اجرا و بافرهاي بلات با Tris بافر مي شوند. همه بافرهاي متداول در دسترس هستند و يا اگر ترجيح مي دهيد بافر Tris خود را بسازيد ، مي توانيد با پودر Tris خالص ، گليسين و ساير معرف هاي بافر درجه زيست شناسي مولكولي شروع كنيد.
اكثر ژل هاي SDS از سيستم بافر ناپيوسته Tris استفاده مي كنند. ژل انباشته ، كه داراي منافذ بزرگي است به طوري كه پپتيدهاي بزرگتر مي توانند به راحتي از طريق آن جا به جا شوند ، معمولاً در pH 6.7-6.8 فرموله مي شود. در اين pH ، يون هاي كلريد يونيزه به سرعت جا به جا مي شوند ، pH را در پشت سر خود بالا مي برند و يك گراديان ولتاژ با يك منطقه با رسانايي كم ايجاد مي كنند ، كه باعث يونيزه شدن گليسين (از بافر در حال اجرا) و كلريد مي شود. اكثر پپتيدهاي موجود در نمونه ، كه به دليل اتصال متصل به SDS داراي بار منفي هستند ، بين كلريد و گليسين جا به جا مي شوند و يك باند باريك تشكيل مي دهند و بنابراين “انباشته” مي شوند.
هنگامي كه انباشته به ژل حلال رسيد ، كه در pH بالاتر است (به طور معمول pH 8.7-8.8) ، افزايش يونيزاسيون گليسين باعث تسريع و پيشي گرفتن پپتيدها مي شود. علاوه بر اين ، اندازه منافذ كوچكتر ژل حل كننده شروع به اثر الك مي كند ، و در نتيجه پپتيدها بر اساس اندازه از هم جدا مي شود .
بيشتر پروتكل هاي وسترن بلات از يك بافر Tris با قدرت يوني پايين براي انتقال پروتئين استفاده مي كنند. زمان انتقال به نوع دستگاه بلات و محدوده اندازه پپتيد مورد نظر بستگي دارد.
استفاده از بافر Tris در الكتروفورز اسيد نوكلئيك آگارز
از بافرهاي Tris به طور گسترده اي براي الكتروفورز DNA آگارز استفاده مي شود. دو بافر اصلي TBE (تريس بورات / EDTA) و TAE (تريس استات / EDTA) هستند. اگرچه تفاوت هايي در وضوح اشكال مختلف DNA و تحرك آنها در حين الكتروفورز وجود دارد ، اما از اين بافرهاي Tris به طور كلي مي توان به جاي يكديگر استفاده كرد. يون هاي بورات موجود در TBE بسياري از آنزيم ها را مهار مي كند ، بنابراين بدون انجام برخي از انواع تصفيه DNA پس از الكتروفورز ، ممكن است برخي از عملكرد هاي downstream با واسطه آنزيم كار نكنند. بنابراين ، بافر TAE براي استفاده روزمره در بيشتر آزمايشگاه هاي DNA مورد استفاده قرار مي گيرد
ساخت بافر تريس
بافر Tris براي اكثر سيستم هاي بيولوژيكي انتخاب خوبي است زيرا pKa آن تقريباً 8.1 در 25 درجه سانتي گراد است و آن را به يك بافر موثر در محدوده pH 7–9 تبديل مي كند. اين محدوده pH براي اكثر فرآيندهاي بيولوژيكي مناسب است.
روش معمول ساخت بيشتر بافرهاي Tris كه معمولاً استفاده مي شود ، شروع فقط با پايه Tris است. مقدار مناسب پودر Tris در آب حل مي شود ، pH با HCl تنظيم مي شود و سپس بافر تا حجم مورد نظر ساخته مي شود. با فرض اينكه در هنگام تنظيم pH ، هيچ جابجايي وجود نداشته باشد ، اين روش قدرت يوني را تغيير نمي دهد. اما ، پس از افزايش بيش از حد و تنظيم مجدد آن با NaOH يا استفاده از Tris HCl و تنظيم pH با NaOH ، تغيير در قدرت يوني ايجاد مي شود. بسته به استفاده مورد نظر از بافر تريس ، چنين تغييري ممكن است مهم باشد يا نباشد.
هنگام ساخت بافر تريس ، استفاده از الكترود سازگار با تريس هنگام تنظيم PH بسيار مهم است. الكترودهاي Ag / AgCl با يك اتصال مي توانند ناپايداري را هنگام استفاده با بافرهاي تريس نشان دهند زيرا نقره به تدريج رسوب مي كند در نتيجه استفاده از الكترودهاي مرجع دو اتصال يا كالومل اندازه گيري دقيق PH را در بافر تريس تضمين مي كند .
كد مرك 100979
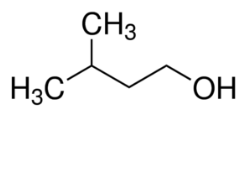
الكل ايزوآميل يا 3-متيل بوتانول شناخته مي شود ، در گروه تركيبات آلي است كه به عنوان الكل هاي اوليه شناخته مي شوند. الكل هاي اوليه تركيباتي هستند كه از گروه عملكردي تشكيل مي شوند. ايزواميل الكل مايعي شفاف و بي رنگ با فرمول شيميايي CH3)2CHCH2CH2OH) است. اين تركيب غير سمي داراي بوي نامطبوع و عامل خفگي است. چگالي آن كمتر از آب است ، در آب محلول است و روي آب شناور مي ماند. كاربرد اصلي آن در صنعت به عنوان ماده افزودني و طعم دهنده مواد غذايي است. اين ماده از نفت سبك با تقطير كسري توليد مي شود. بنابراين ، يك مولكول چربي، الكل چرب در نظر گرفته مي شود. به عنوان يك تركيب جامد ، محلول و يك تركيب اسيدي بسيار ضعيف وجود دارد. در چندين مايعات بيولوژيكي مانند مدفوع و بزاق شناسايي شده است. در همه يوكاريوت ها وجود دارد ، از مخمر گرفته تا انسان. يك تركيب الكلي ، توليد عناصر روغن موز استر است كه در طبيعت يافت مي شود و همچنين به عنوان طعم دهنده در صنعت توليد مي شود. اين يك الكل فيوزل رايج است كه به عنوان يك محصول اصلي از تخمير اتانول توليد مي شود.و در تعدادي از مواد غذايي مانند گلابي ، هويج وحشي و عناب يافت مي شود. اين امر نشانگر زيستي بالقوه براي مصرف اين محصولات غذايي را بيان مي كند. به اختلالات متابوليكي مادرزادي از جمله بيماري سلياك مرتبط است.























 محيط كشت نوترينت آگار
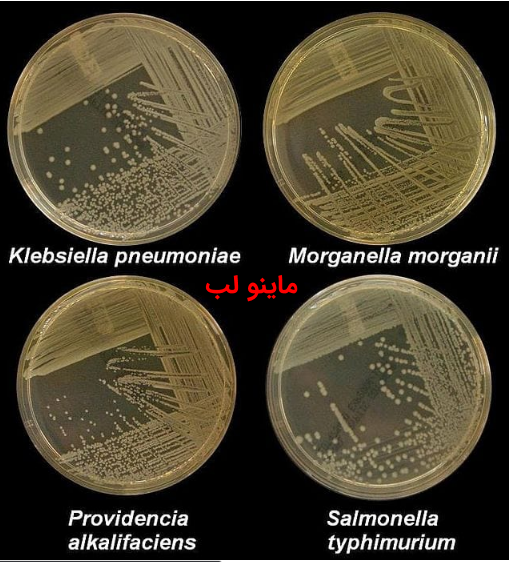
محيط كشت نوترينت آگار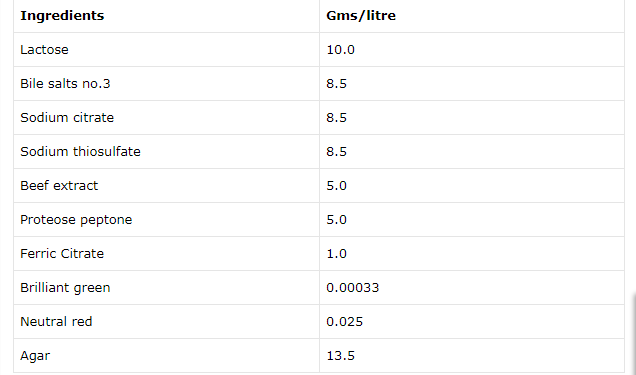 محيط سالمونلا شيگلا چيست؟
محيط سالمونلا شيگلا چيست؟ محيط كشت XLD
محيط كشت XLD محيط كشت TSA چيست
محيط كشت TSA چيست محيط كشت MHA چيست
محيط كشت MHA چيست محيط كشت مك كانكي چيست
محيط كشت مك كانكي چيست محيط كشت of چيست
محيط كشت of چيست محيط كشت بلاد آگار چيست
محيط كشت بلاد آگار چيست